Tofacitinib zitratoa (Xeljanz izen komertziala) errezetazko sendagaia da, jatorriz Pfizer-ek garatua ahozko Janus kinasa (JAK) inhibitzaileen klase baterako. JAK kinasa selektiboki inhibitu dezake, JAK/STAT bideak blokeatu eta, ondorioz, zelulen seinaleen transdukzioa eta erlazionatutako geneen adierazpena eta aktibazioa inhibitu ditzake, artritis erreumatoidea, artritis psoriasikoa, kolitis ultzeragarria eta beste gaixotasun immunologikoak tratatzeko erabiltzen dena.
Drogak hiru dosi forma ditu: pilulak, askapen iraunkorreko pilulak eta ahozko soluzioak. Bere pilulak FDAk 2012an onartu zituen lehen aldiz, eta askapen iraunkorreko dosi forma 2016ko otsailean onartu zuen FDAk. Artikulazio erreumatoideak tratatzen dituen lehena da. Yan egunean behin ahoz hartzen den JAK inhibitzailea da. 2019ko abenduan, askapen iraunkorreko sendagaien indikazio berri bat onartu zen berriro ultzerako kolitis aktibo moderatua eta larria (UC). Horrez gain, plaken psoriasiaren egungo 3. faseko entsegu klinikoak burutu dira, eta beste sei faseko 3. faseko entsegu klinikoak egiten ari dira, artritis psoriasiko aktiboa, gazteen artritis idiopatikoa, etab. Mota honetako zantzuak. Ekintza luzea duten eta egunean behin bakarrik hartu behar diren askapen iraunkorreko pilulen abantailak lagungarriak dira pazienteen gaixotasunak kudeatzeko eta kontrolatzeko.
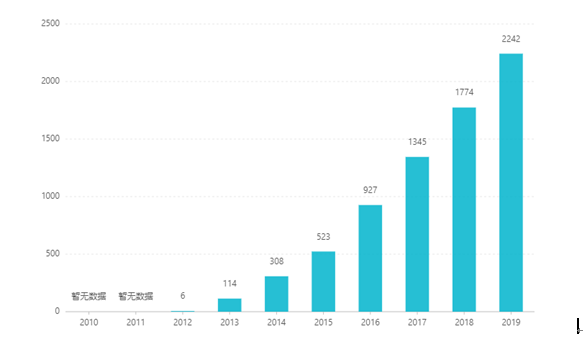
Kostatu zenetik, bere salmentak handitu egin dira urtez urte, 2019an 2.242 milioi USD-ra iritsi arte. Txinan, tabletaren dosi forma 2017ko martxoan merkaturatzeko onartu zen, eta 2019an negoziazioen bidez sartu zen aseguru medikoen kategoriako B katalogoan. Azken irabazlea eskaintza 26,79 RMB da. Hala ere, askapen iraunkorreko prestakinen oztopo tekniko handiak direla eta, dosi forma hau oraindik ez da Txinan merkaturatu.
JAK kinasak paper garrantzitsua betetzen du hanturan, eta bere inhibitzaileek zenbait gaixotasun hanturazko eta autoimmune tratatzen dituztela frogatu da. Orain arte, 7 JAK inhibitzaile onartu dira mundu osoan, besteak beste, Leo Pharma-ren Delgocitinib, Celgene-ren Fedratinib, AbbVie-ren upatinib, Astellas-en Pefitinib, Eli Lilly-ren Baritinib eta Novartis-en Rocotinib. Hala ere, tofacitinib, baritinib eta rocotinib baino ez dira onartzen Txinan aipatutako botiken artean. Espero dugu Qilu-ren "Tofatib Citrate Askapen Iraunkorako Tabletak" onartzea ahalik eta azkarren eta paziente gehiagoren onurarako.
Txinan, jatorrizko ikerketa tofacitib zitratoa NMPAk onartu zuen 2017ko martxoan metotrexatoarekiko eraginkortasun edo intolerantzia nahikorik ez duten RA paziente helduen tratamendurako, Shangjie izen komertzialarekin. Meinenet-en datuen arabera, 2018an Txinako mediku-erakunde publikoetan tofacitib zitrato pilulen salmenta 8,34 milioi yuanekoa izan zen, hau da, bere salmenta globalak baino askoz txikiagoa. Arrazoiaren zati handi bat prezioa da. Jakinarazten da Shangjie-ren hasierako txikizkako prezioa 2085 yuanekoa izan zela (5mg * 28 pilulak), eta hileko kostua 4170 yuanekoa izan zela, eta hori ez da zama txikia familia arruntentzat.
Hala ere, merezi du tofacitib 2019ko "Oinarrizko Medikuntza Aseguru Nazionala, Laneko Istripuen Asegurua eta Amatasunaren Aseguru Medikuen Zerrendan" sartu zuela, 2019ko azaroko negoziazioen ondoren Medikuntza Aseguruen Administrazio Nazionalak. Jakinarazten da hileko kuota murriztuko dela. 2.000 yuanetik beherako prezioa negoziatu ondoren, eta horrek asko hobetuko du sendagaiaren erabilgarritasuna.
2018ko abuztuan, Jabetza Intelektualaren Estatuko Bulegoko Patenteak Berriz Aztertzeko Batzordeak baliogabetzeko 36902 zenbakiko berrikuspen-erabakia egin zuen, eta baliogabetzat jo zuen Pfizertofatib-en, patente konposatuaren, oinarrizko patentea, zehaztapena nahikoa ezagutarazi ez zuelako. Hala ere, Pfizertofatiib kristal formaren patentea (ZL02823587.8, CN1325498C, eskaera data 2002.11.25) 2022an iraungiko da.
Insight datu-baseak erakusten du, jatorrizko ikerketaz gain, Chia Tai Tianqing, Qilu, Kelun, Yangtze River eta Nanjing Chia Tai Tianqing-en bost sendagai generiko onartu direla tofacitinib tabletaren formulazio domestikoetan merkaturatzeko. Hala ere, askapen iraunkorreko tablet motarako, jatorrizko ikerketa Pfizer-ek soilik aurkeztu zuen marketin-eskaera maiatzaren 26an. Qilu da formulazio honen merkaturatze-eskaera aurkeztu duen lehen enpresa nazionala. Horrez gain, CSPC Ouyi BE epaiketa fasean dago.
Changzhou Pharmaceutical Factory (CPF) APIen fabrikatzaile farmazeutiko liderra da, Txinan amaitutako formulazioak, Changzhou-n kokatuta, Jiangsu probintzian. CPF 1949an sortu zen. 2013tik aurrera Tofacitinib Citratean eman dugu, eta DMF aurkeztu dugu dagoeneko. Herrialde askotan erregistratu gara, eta Tofacitinib Citrate-rako dokumentu onenekin lagundu genezake.
Argitalpenaren ordua: 2021-07-23